












Автор рисунка: Юлианна Теннант

14:28 05.12.2013



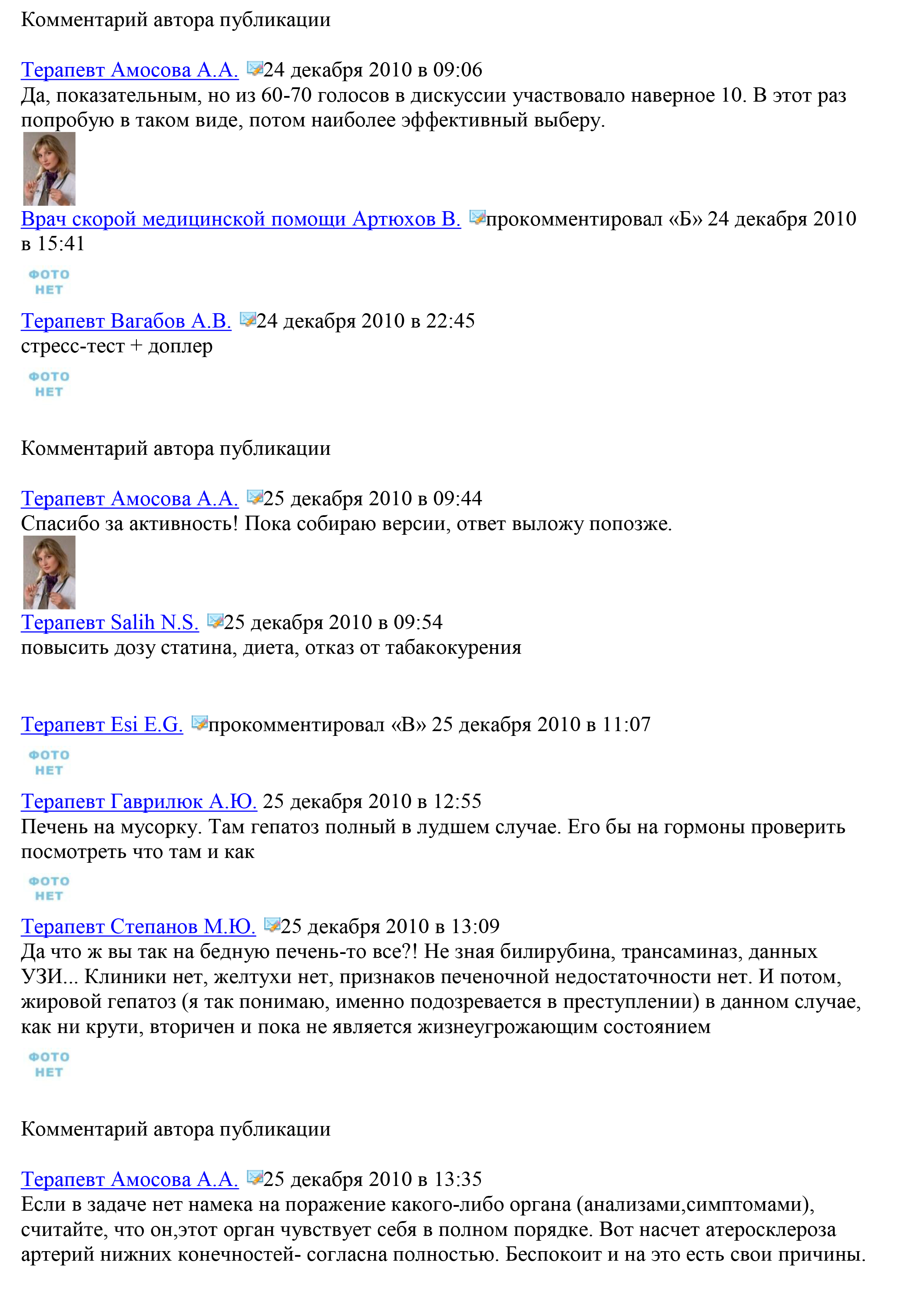 Синдром раздраженного кишечника или нечто большее?
Синдром раздраженного кишечника или нечто большее?

 19:45 04.12.2013
Профилактика инсультов. Конспект врача
Вавилова Т.В. Предупреждение ишемических инсультов
1).Варакин Юрий Яковлевич
доктор медицинских наук, руководитель лаборатории эпидемиологии и профилактики сосудистых заболеваний мозга НИИ неврологии РАМН (Центр по изучению инсульта Минздрава России) 1998 год
2).Т.В.Вавилова, профессор СПБ 2013 год
"Предупреждение ишемических инсультов кардиооэмболического генеза - современный подходы"
Северо-Западный государственный медицинский университет им.И.И.Мечникова
Новые оральные антикоагулянты:перечень
преимуществ
*НОА имеют пресказуемую фармакодинамику
*Небольшое количество взаимодействия с другими
лекарственными средствами и пищей
*Точка приложения ограничена одним фактором
свертывания
*Широкий терапевтический диапазон
*Рутинный контроль коагуляции не требуется
*Могут быть использованы в фиксированных дозах
*Улучшенное соотношение риска и ожидаемой пользы
Клинические исследования новых
оральных антикоагулянтов 3 фазы
Прямые ингибиторы
Дабигатран
Прямые ингибиторы фактора
Ривароксабан
Апиксабан
Эдоксабан
Европейский опрос врачей: профилактика ишемического инсульта
18 июля 2013 года, 09:34
18:05 04.12.2013
Аутоиммунный гепатит (АГ)
19:45 04.12.2013
Профилактика инсультов. Конспект врача
Вавилова Т.В. Предупреждение ишемических инсультов
1).Варакин Юрий Яковлевич
доктор медицинских наук, руководитель лаборатории эпидемиологии и профилактики сосудистых заболеваний мозга НИИ неврологии РАМН (Центр по изучению инсульта Минздрава России) 1998 год
2).Т.В.Вавилова, профессор СПБ 2013 год
"Предупреждение ишемических инсультов кардиооэмболического генеза - современный подходы"
Северо-Западный государственный медицинский университет им.И.И.Мечникова
Новые оральные антикоагулянты:перечень
преимуществ
*НОА имеют пресказуемую фармакодинамику
*Небольшое количество взаимодействия с другими
лекарственными средствами и пищей
*Точка приложения ограничена одним фактором
свертывания
*Широкий терапевтический диапазон
*Рутинный контроль коагуляции не требуется
*Могут быть использованы в фиксированных дозах
*Улучшенное соотношение риска и ожидаемой пользы
Клинические исследования новых
оральных антикоагулянтов 3 фазы
Прямые ингибиторы
Дабигатран
Прямые ингибиторы фактора
Ривароксабан
Апиксабан
Эдоксабан
Европейский опрос врачей: профилактика ишемического инсульта
18 июля 2013 года, 09:34
18:05 04.12.2013
Аутоиммунный гепатит (АГ)
Патогенез АГ сложен. Полагают, что это ответ генетически предрасположенного организма на какой-то внешний агент, который является пусковым моментом в развитии аутоиммунных процессов, вызывающих прогрессирующие воспалительно-некротические изменения, приводящие к фиброзу и циррозу печени (ЦП). Генетически детерминированная предрасположенность к этому заболеванию выявлена во многих исследованиях. Доказано, что большая часть больных АГ имеют фенотип по антигенам главного комплекса гистосовместимости HLA-B8, HLA-DR4, DR3 и DR52a. Пусковой агент пока неизвестен, однако есть некоторые данные о роли вирусов гепатита [31, 26], кори [27], Эпштейн-Барр вируса [32], а также интерферона (ИФН) [14] как инициаторов начала АГ. Аутоиммунный гепатит (АГ) — хроническое воспалительное заболевание печени невыясненой этиологии, характеризующееся определенными лабораторными, клиническими и гистологическими признаками. Болеют им в основном женщины молодого возраста АГ — это прогрессирующее воспаление печени, характеризующееся наличием некрозов в перипортальной, септальной зонах (ступенчатые некрозы) или, более широко, лобулярным гепатитом (ЛГ), гипергаммаглобулинемией и аутоантителами в сыворотке крови [7]. Портальные тракты печени на биоптатах находят расширенными с накоплением в них обширных инфильтратов, имеющих разный клеточный состав: лимфоциты, макрофаги, плазматические клетки. ЛГ — дольковый гепатит, когда некрозы выявляются во второй и третьей зонах ацинусов, а также обнаруживается внутридольковая лимфоидноклеточная инфильтрация, которая выражена значительно больше, чем инфильтрация портальных трактов. ЛГ является частью гистологической картины АГ, если он выявляется одновременно с перипортальным гепатитом. По гистологической картине на АГ может указывать, кроме вышеперечисленного, наличие многоядерных гепатоцитов [2]. Наконец, картина фиброза может присутствовать в той или иной степени даже при умеренной степени активности АГ, а в запущенных случаях, особенно при отсутствии эффективной терапии, формируются мостовидные некрозы и, в конце концов, ЦП. Хотя гистологическая картина при АГ очень характерна, все-таки она неспецифична. Отличительной чертой АГ является обнаружение в биоптатах преимущественно плазматических клеток, так как выраженная инфильтрация в портальной, перипортальной зоне, вовлечение в процесс долек печени — в равной мере присущи и хроническому вирусному гепатиту (ХВГ). Одной из основных клинических характеристик АГ является обнаружение аутоантител к клеточным и субклеточным структурам клеток разных органов [22]. Типичным маркером АГ являются антитела к ядрам клеток — ANA. Из других маркеров выявляются антитела к клеткам гладкой мускулатуры (SMA), антитела к микросомам клеток печени и эпителиальных клеток клубочкового аппарата почек (LKM), антитела к растворимому печеночному антигену (SLA), антитела к антигенам (цитокератины 8, 18) мембран гепатоцитов — LMA. Клинические проявления АГ очень разнообразны [1, 3, 4]. С одной стороны, встречаются бессимптомные формы, когда случайно выявляется повышение АЛТ, АСТ, а с другой — острое начало болезни с тяжелым течением вплоть до развития фульминантного гепатита (ФГ). Нередко заболевание начинается незаметно с астеновегетативных проявлений, болей в области правого предреберья, незначительной желтухи. Однако у большинства больных АГ начало болезни острое, как при остром вирусном гепатите (ОВГ), и при осмотре пациента врач впервые выявляет признаки хронического гепатита (ХГ) — телеангиоэктазии, пальмарную эритему, увеличение печени и селезенки, а также изменения в анализах крови — гипергаммаглобулинемию, увеличение IgG, снижение содержания общего белка, резкое увеличение СОЭ. Лейкопения и тромбоцитопения наблюдаются у больных на поздних стадиях болезни или при развившихся гиперспленизме и синдроме портальной гипертензии. Когда АГ впервые проявляется желтухой, как при ОВГ, приходится дифференцировать его от гепатитов А, В, Е и особенно С, при котором антитела в сыворотке крови могут появляться через достаточно продолжительное время после начала болезни. Желтуха у пациентов с АГ может быть разной степени выраженности, часто появляется на поздних стадиях заболевания, бывает непостоянной и усиливается в период обострений. В общем же у большинства больных чаще всего изменяются аминотрансферазы, нежели щелочная фосфотаза (ЩФ) или билирубин. Аутоиммунный гепатит был выделен из группы болезней печени и впервые описан как отдельная нозология в начале 50-х годов [33]. В научной литературе существовал под разными названиями. Термин люпоидный гепатит, который часто использовался в нашей стране, ввел в 1956 году Дж. Маккей с соавторами в журнале Lancet, так как при этом заболевании нередко в сыворотке крови больных выявлялись волчаночные клетки. Потом, в последующие годы, люпоидный, или классический, АГ стали называть аутоиммунным активным хроническим гепатитом, но в 1993 году Международная группа по изучению болезней печени предложила термин АГ, а также критерии установления его диагноза [17] Для АГ характерно поражение кожи в виде геморрагической сыпи, оставляющей после себя пигментацию. Из других симптомов встречаются волчаночная и узловатая эритемы, очаговая склеродермия, пальмарная эритема и телеангиоэктазии. У всех больных выявляются изменения в эндокринной системе — аменорея, угри, гирсутизм, стрии. Диагностическое значение отдельных симптомов болезни при АГ неодинаково. К наиболее значимым относятся длительная лихорадка и арталгии. В большинстве случаев АГ они присутствуют одновременно, являясь наиболее частыми и постоянно встречающимися жалобами больных [4]. Один из вариантов начала АГ — появление лихорадки с внепеченочными проявлениями, из которых следует назвать аутоиммунный тиреоидит, язвенный колит, гипертиреоидизм, гемолитическая анемия, идеопатическая тромбоцитопения, сахарный диабет, целиакия, полимиозит, фиброзирующий альвеолит, гломерулонефрит и т. д. Желтуха при этом варианте появляется позже [20]. Часто АГ сопровождается бесплодием, однако при возникновении беременности и последующих родах на фоне компенсированного процесса это не влияет на течение АГ и судьбу ребенка даже при постоянном приеме преднизолона (ПР) [30]. Беременность на стадии сформировавшегося ЦП и синдрома портальной гипертензии, которые выявляются у трети больных на момент выявления АГ, нежелательна [3]. В отличие от ХВГ течение АГ у больных непрерывно прогрессирующее, без самопроизвольных ремиссий. Улучшения самочувствия бывают кратковременными, нормализации биохимических процессов не происходит. Прогноз течения АГ хуже у пациентов с острым началом болезни по типу ОВГ, с наличием признаков холестаза, асцитом, повторными эпизодами острой печеночной энцефалопатии (ОПЭ). Как правило, больные, пережившие критический период, имеют лучший прогноз. Диагноз АГ выставляется на основании соответствия лабораторных и гистологических данных, отсутствия маркеров ВГ, исключения злоупотребления алкоголем и контактов с препаратами крови, гипотоксическими веществами, повышения гамма-глобулинов не менее чем в 1,5 раза выше нормы. Повреждение желчных протоков, отложение меди, гемосидероз, при которых также могут выявляться ЛГ и ступенчатые некрозы, предполагают другую причину ХГ и исключают диагноз АГ. ANA, SMA и LRM-1 должны быть в титрах не менее 1:80 у взрослых и 1:20 у детей (рекомендации Международной группы, 1993). Дифференциальный диагноз между АГ и другими аутоиммунными заболеваниями, в основном первичным билиарным циррозом (ПБЦ), первичным склерозирующим холангитом (ПСХ), ХВГ основывается на клинических, гистологических и иммунологических параметрах. Однако нередко выявляется так называемый overlap-синдром, когда одновременно у пациентов выявляются признаки АГ и вышеперечисленных хронических заболеваний печени. Далее они будут описываться как варианты АГ [7, 13]. Предполагаемый диагноз АГ в данном случае подразумевает сходство с клиникой АГ (жалобы на слабость, арталгии, миалгии), а биохимический анализ крови отражает преимущественно изменения холестатического порядка, имеет место кожный зуд разной степени выраженности. Пациенты с такими вариантами АГ могут быть обоего пола, любого возраста, но все же чаще это женщины в возрасте до 40 лет и моложе. На гистологии находят перипортальный гепатит с или без ЛГ, часто с поражением желчных протоков, жировой дистрофией гепатоцитов и лимфоидной инфильтацией портальных трактов в виде гранулем [7, 10]. Современная классификация АГ выделяет следующие подтипы Подтип 1 – классический АГ, на его долю приходится около 85% всех случаев. При этом варианте выявляются ANA, AMA, LMA Подтип 2 – две трети пациентов, страдающих этим вариантом, составляют дети, нередко болеют люди пожилого возраста, частота заболевания среди лиц мужского и женского пола одинакова, мало изменяются уровни АЛТ, АСТ. Характерно обнаружение LKM-1-антител [16]. LKM-антитела имеют разные подтипы: LKM-2 выявляют при лекарственном гепатите, LKM-3 обнаруживается у 20% больных дельта-гепатитом Подтип 3 – характерно выявление SLA, а также анти-LP-антител к гепатоцитам и клеткам поджелудочной железы Деление АГ на подтипы практического значения не имеет, однако следует иметь в виду, что подтип 2 АГ может быть связан с гепатитом С либо HCV может индуцировать появление АГ у генетически предрасположенных лиц. Нет данных о различиях гистологической картины при отдельных подтипах АГ Вариант АГ и ПБЦ Большинство больных с ПБЦ можно точно отделить от пациентов с АГ с помощью характерных лабораторных и иммунологических данных. Однако при этом варианте наряду с характерными параметрами АГ нередко выявляются гистологические признаки холангита и АМА (антитела к антигенам внутренней поверхности мембраны митохондрий), что очень характерно для ПБЦ. Наиболее важным для подтверждения диагноза ПБЦ является обнаружение АМА подтипа М2 [6]. АМА выявляются у 20-27% больных АГ в разных титрах [19]. Это может отражать диагностические ошибки в определении иммуносерологических маркеров, другие заболевания или одну из стадий ПБЦ. Если у больного повышена щелочная фосфатаза (ЩФ), IgM сыворотки крови и обнаружена АМА — вероятен диагноз ПБЦ. Трех-шестимесячный курс лечения стероидами помогает расшифровать преобладающую патологию — при реакции на лечение можно говорить о превалировании АГ. Вариант АГ и ПСХ Установлено, что у 16% больных АГ выявляется язвенный колит (ЯК), наличие которого характерно для пациентов с ПСХ (от 40 до 60% больных). К тому же при таком сочетании — АГ и признаки ПСХ (наличие ЯК, поражение желчных протоков, слабый ответ на стероиды) — также обнаруживают фенотип HLA-B8, HLADR3, HLA DR4. Поэтому наличие кожного зуда у больных АГ и повышение ЩФ более чем в четыре раза против нормы указывают на необходимость проведения холангиографии (ХГР) и вероятность развития варианта АГ и ПСХ. Поражения желчных протоков несовместимы с диагнозом АГ. Они редки, но когда появляются у больных АГ с сопутствующей патологией кишечника или атипичным повышением ЩФ, можно допустить этот вариант АГ. Окончательный диагноз зависит от результатов ХГР. ХГР выявляет признаки склерозирующего холагнита у 42% больных АГ и ЯК. Но иногда ХГР бывает в норме у 14% больных ПСХ при гистологически подтвержденном диагнозе. Об этом необходимо помнить [24]. Вариант АГ и ХВГ АГ считается заболеванием невирусной этиологии, но у 4% больных АГ выявляются антиHCV и еще у 4% — маркеры вируса гепатита В. Больные АГ, имеющие атипичное течение болезни либо плохо отвечающие на терапию стероидами, нередко имеют в сыворотке крови HCV RNA. Любопытно, что 11% больных ХВГ имеют SMA и 28% — ANA. У 62% выявляются аутоантитела к щитовидной железе и ревматоидный фактор. Большая часть этих больных имеют низкие титры SMA и ANA (1:80 и ниже), а пациенты с точным диагнозом АГ — SMA в титрах 1:160 и ANA 1:320. Поэтому больные АГ и с выявляемыми SMA или ANA в титрах ниже 1:320 могут быть отнесены к группе с превалированием вирусного заболевания [11]. Тем не менее пациенты с АГ имеют более выраженную инфильтрацию портальных трактов плазматическими клетками, более выраженные воспалительные изменения в дольках и больше ступенчатых и перисептальных некрозов по сравнению с пациентами ХВГ, особенно ХГС. У больных ХВГ/ХГС наоборот — в портальных трактах преобладает лимфоидноклеточная инфильтрация, чаще выявляется стеатоз и повреждения желчных протоков, особенно при ХГС. Криптогенный ХГ У 13% взрослых больных с признаками АГ не обнаруживаются аутоантитела, а все остальные признаки — иммунологические, биохимические и гистологические, а также возраст и пол соответствуют критериям постановки диагноза АГ. Что важно, эти больные также хорошо реагируют на лечение стероидами [8, 9]. Отмечено, что с течением времени при динамическом наблюдении у некоторых из них появляются соответствующие аутоантитела, характерные для АГ. Несмотря на разнообразие клинической картины, при АГ основой лечения является назначение преднизолона (ПР). Ответ на данную терапию — один из критериев постановки диагноза АГ. Целесообразность назначения ПР при АГ доказана в многочисленных исследованиях и обусловлена редкими самопроизвольными ремиссиями в течении болезни, высокой смертностью и ухудшением качества жизни [12, 18, 23, 28, 29]. При назначении ПР смертность удается снизить в течение пяти лет с 50 до 20%, а частоту индуцированных ремиссий довести до 80%. У большинства больных ремиссии появляются в течение первых двух лет терапии и почти у всех в последующие четыре года лечения. Лечение ПР следует назначать всем больным АГ высокой степени активности с фиброзом и циррозом или без. У больных с умеренной степенью активности болезни назначение ПР часто определяется наличием жалоб и симптомов болезни. Больные без симптомов и с умеренной степенью активности процесса по гистологической картине не нуждаются в лечении, но должны тщательно и регулярно наблюдаться для своевременного выявления признаков прогрессирования болезни. Как правило, начальная доза ПР составляет 20-30 мг/сутки с последующим постепенным снижением ее до поддерживающей — обычно 10 мг/сутки. Из всех схем лечения предпочтителен ежедневный прием однократно утром. Осложнения терапии наблюдаются при дозе более 10 мг/сутки. Нет точных рекомендаций по отмене или снижению дозы иммуносупрессоров, некоторые больные могут долго оставаться в ремиссии после отмены ПР. Однако было установлено, что у большей части больных в дальнейшем, даже спустя несколько лет после ремиссии, появляются признаки обострения и часто требуется большая доза для ее достижения [15]. Комбинация ПР с азатиоприном (АЗА) может уменьшить побочные эффекты (при этом требуется небольшая доза ПР). Лучше давать 10 мг/сутки ПР с 50 мг/сутки АЗА, чем один ПР, но в большей дозе. Сам АЗА не способен индуцировать ремиссию, но его добавление к ПР поддерживает ее даже в дозе 1 мг/кг/сутки. При неэффективности лечения АЗА назначали 6-меркаптопурин с хорошим эффектом [25]. У 20% больных АГ не удается достигнуть ремиссии — чаще всего у пациентов с признаками ЦП, лиц молодого возраста, при длительном анамнезе болезни до начала терапии ПР и у больных с фенотипом HLA-B8, DR3 [28]. Побочные эффекты при назначении иммунодепрессантов редкие, это в основном диспепсический синдром, сыпи, кушингоидизм, нарушение роста и развития у детей, сахарный диабет и остеопороз у женщин в менопаузе. АЗА может индуцировать миелосупрессию, возникновение катаракты, обладает онкогенным и, возможно, тератогенным эффектами. Лечение вариантов АГ представляет определенные трудности. Основа терапии, препарат выбора для начала лечения — и здесь ПР. При сочетании АГ и ПБЦ назначают ПР в дозе 20 мг/сутки от трех до шести месяцев, а при отсутствии эффекта — урсодезоксихолевую кислоту (УДХК) или ее коммерческие препараты (урсофальк, урсосан, урсодиол и др.) по 13-15 мг/сутки от трех до шести месяцев. Тактика лечения больных с вариантом АГ и ПСХ та же, что и при АГ и ПБЦ. Больные АГ и ЯК отвечают на терапию ПР хуже, чем больные с одним АГ (не столь часты ремиссии, чаще и быстрее выявляют прогрессирование к ЦП). Эти пациенты, возможно, должны лечиться УДХК большими дозами (до 15-20 мг/кг/сутки), если признаки холестаза выражены. При сочетании АГ и ХВГ назначают ПР 20 мг/сутки или 10 мг/сутки ПР и 50 мг/сутки АЗА на три–шесть месяцев, если превалируют признаки АГ. Рекомбинантный ИФН в дозе 3 млн. МЕ/сутки три раза в неделю до 6 месяцев назначают при выявлении признаков ХВГ и маркеров репликации вируса либо неэффективности стероидной терапии [21, 5]. Лечение таких больных представляет собой сложную задачу, так как ПР усиливает вирусную репликацию, а ИФН может усилить иммуноопосредованный печеночно-клеточный некроз, перевести ХВГ в АГ, который до этого мог быть в латентном состоянии, обострить течение болезни с развитием внепеченочных аутоиммунных проявлений, индуцировать выброс антител с неясным клиническим значением. Поэтому лечение состоит в правильном определении преобладания тех или иных клинических синдромов или признаков. В любом случае обострение болезни печени или внезапное появление признаков аутоиммунного заболевания у пациентов с признаками АГ, но с преобладанием вирусного поражения указывает на необходимость прерывания лечения ИФН. Тактика лечения больных криптогенным ХГ состоит в назначении ПР 10-20 мг/сутки вместе с 50 мг/сутки АЗА до появления ремиссии или максимального эффекта. Результаты общеевропейского онлайн-опроса с участием 1000 врачей показывают, что более двух третей врачей считают профилактику ишемического инсульта наиболее важной задачей в терапии пациентов с фибрилляцией предсердий (ФП). Ишемический инсульт является наиболее распространенным типом инсульта у пациентов с ФП, и в силу этого врачи по всей Европе придают жизненно важное значение повышению осведомленности об истинной частоте возникновения ишемических инсультов и их влиянии на эту группу пациентов. Результаты опроса были объявлены во время Европейской конференции по инсульту, прошедшей в Лондоне 28-31 мая. Согласно данным опроса, врачи считают необходимыми предоставление пациентам дополнительной информации и просветительскую работу, посвященную информированию общественности о степени риска и влиянию ишемического инсульта на жизнь пациентов с ФП. Каждый год до трех миллионов пациентов с ФП переносят инсульт. 92% всех случаев инсульта у пациентов с ФП приходится на ишемические инсульты. Они происходят в том случае, когда кровеносный сосуд, снабжающий головной мозг кровью, оказывается заблокированным, например, сгустком крови (тромбом). Снижение или полное прекращение кровотока в головном мозге может привести к тяжелым физическим поражениям, параличу и даже смерти пациента. Фибрилляция предсердий является наиболее распространенным стойким нарушением ритма сердца, от которого страдает примерно 2% населения планеты. Данное нарушение увеличивает риск инсульта в пять раз. «Каждый врач, занимающийся лечением пациентов с фибрилляцией предсердий, должен осознавать риск ишемического инсульта у них, – комментирует Ханс-Кристоф Динер, профессор неврологии и глава отделения неврологии университета Эссен, Германия. – Сегодня у нас имеются потрясающие новые возможности, позволяющие предотвратить инсульт путем скрининга, постановки диагноза, оценки риска и обеспечения в меру наших сил дальнейшей защиты таких пациентов от возможных последствий ишемического инсульта или внутричерепного кровоизлияния». Участниками онлайн-опроса MedLIVE? PULSE стали кардиологи и врачи общей практики (ВОП) семи европейских стран, которые выразили свое мнение относительно основных приоритетов в терапии ФП. В ходе опроса, в том числе, были изучены факторы, влияющие на назначение лекарственных препаратов: 67% врачей считают, что профилактика ишемического инсульта является наиболее важной целью лечения пациентов с ФП, 84% врачей придают жизненно важное значение повышению осведомленности о влиянии ишемического инсульта среди пациентов с ФП, утверждая, что истинная частота возникновения может быть недооценена, 56% врачей сообщили, что защита пациентов от ишемического инсульта является единственным приоритетным фактором, влияющим на их решения о назначении препаратов, на втором и третьем местах идут общая эффективность лечения (защита от всех типов инсульта) и безопасность лечения (минимизация риска кровотечения у пациентов), 50% врачей указали, что наличие клинических данных является наиболее важным фактором, заслуживающим рассмотрения, 39% врачей предпочли опыт применения в клинической практике удобству применения препарата на ежедневной основе. «Ишемический инсульт является серьезной проблемой не только из-за весьма высокого риска, но также из-за потенциального влияния, которое он может оказать на жизнь пациентов с фибрилляцией предсердий. Ишемический инсульт может нанести сокрушительный удар как по самим пациентам, так и по их семьям. Кроме того, данное состояние приводит к увеличению расходов системы здравоохранения и потребности в долговременном уходе, – отметила Труди Лоббан, Кавалер Ордена Британской империи, основатель и генеральный директор Ассоциации фибрилляции предсердий (Atrial Fibrillation Association, AFA). – Нам жизненно необходимо более активно работать над повышением уровня осведомленности о риске ишемического инсульта и обеспечением пациентов с ФП лекарственными препаратами, гарантирующими всеобъемлющую защиту». Адекватная антикоагулянтная терапия способствует профилактике инсульта у пациентов с фибрилляцией предсердий и улучшению результатов лечения в целом. О преимуществах антикоагулянтной терапии при фибрилляции предсердий говорится в рекомендациях по лечению в Европе, США и других странах мира. Препарат Прадакса® (дабигатрана этексилат) в дозировке 150 мг дважды в день является единственным современным антикоагулянтом, который доказанно (в исследовании RE-LY®, в сравнении с варфарином) существенно снижает риск ишемического инсульта: у пациентов с неклапанной ФП препарат Прадакса® в дозировке 150 мг дважды в день снижает риск ишемического инсульта на 25% по сравнению с варфарином. Кроме того, риск внутричерепного кровотечения (наиболее опасного осложнения антикоагулянтной терапии) у пациентов, принимающих препарат Прадакса® в дозировке 150 мг на 59% ниже. По данным исследования RE-LY®, препарат Прадакса® достоверно снижает риск инсульта и системных тромбоэмболий на 35% более эффективно, чем варфарин. Эффективность препарата Прадакса® в дозировке 110 мг 2 раза в сутки для снижения риска инсульта и системных эмболий сопоставима с эффективностью варфарина. В обеих дозировках статистически достоверно снижает риск развития внутричерепных и жизнеугрожающих кровотечений, в дозе 110мг 2 раза в сутки значительно эффективнее снижает риск развития всех тяжелых кровотечений в сравнении с варфарином. Клинический опыт применения препарата Прадакса® превышает аналогичный опыт всех других современных оральных антикоагулянтов и составляет более 1,6 миллионов пациенто-лет по всем зарегистрированным показаниям более чем в 100 странах мира. Лечение инсульта
Вариант АИГ и ПСХ(первичного склер. холангита) Установлено, что у 16% больных АГ выявляется язвенный колит (ЯК), наличие которого характерно для пациентов с ПСХ (от 40 до 60% больных). К тому же при таком сочетании — АГ и признаки ПСХ (наличие ЯК, поражение желчных протоков, слабый ответ на стероиды) — также обнаруживают фенотип HLA-B8, HLADR3, HLA DR4. Поэтому наличие кожного зуда у больных АГ и повышение ЩФ более чем в четыре раза против нормы указывают на необходимость проведения холангиографии (ХГР) и вероятность развития варианта АГ и ПСХ. Поражения желчных протоков несовместимы с диагнозом АГ. Они редки, но когда появляются у больных АГ с сопутствующей патологией кишечника или атипичным повышением ЩФ, можно допустить этот вариант АГ. Окончательный диагноз зависит от результатов ХГР. ХГР выявляет признаки склерозирующего холагнита у 42% больных АГ и ЯК. Но иногда ХГР бывает в норме у 14% больных ПСХ при гистологически подтвержденном диагнозе. Об этом необходимо помнить [24]. Стенокардию себе лечить, как и до того. А то болеют раком, а умирают от инфаркта, неловко. В нашем населенном пункте человека 3-4 лечат это, у меня несколько наблюдается, где не помогает УДХК, там плазмаферез, ЯК (это ко-болезнь при АИГ), лечится как и лечился до того. Всё почти просто. С уважением. Неалкогольный стеатогепатит (НАСГ) представляет собой воспалительную инфильтрацию паренхимы и стромы печени с наличием очаговых некрозов. НАСГ является промежуточным звеном среди последовательных стадий одного патологического процесса (неалкогольного стеатоза и неалкогольного стеатофиброза) и входит в самостоятельное метаболическое заболевание - неалкогольную жировую болезнь печени (НАЖБП). Поскольку в перечне заболеваний МКБ–10 отсутствует единый код, отражающий полноту диагноза НАЖБП, в настоящее время наиболее часто используют: К 76.0 – жировая дегенерация печени, не классифицированная в других рубриках. Среди лабораторных показателей, чаще всего изменяющихся при НАСГ, наиболее часто встречается увеличение в 2-3 раза активности АЛТ и АСТ. По отношению АСТ/АЛТ в большинстве случаев можно дифференцировать НАСГ ( <1) и алкогольное поражение печени (<2). Уровень билирубина обычно нормальный, в 12-17 % случаев уровень его повышается. В 39-59% случаев умеренно повышается активность ЩФ, реже снижается содержание альбумина и протромбина в крови. Возможен гемосидероз с повышением содержания железа в крови. При первичном НАСГ часто развиваются изменения иммунологических показателей, сходные с аутоиммунным гепатитом. Например, в 13-30% случаев выявляют гипергаммаглобулинемию. Хотя антител к гладким мышцам не выявляют, в 40 % случаев появляются ANA в титре 1: 40 – 1: 320. Почти в 20% случаев развивается гиперлипидемия (за счет триглицеридов и холестерина). Нарушения обмена липопротеинов (особенно гиперлипидемия IV типа) нередко (в 54% случаев) наблюдаются при избыточной массе тела (на 50-200% выше нормы); обычно эти нарушения сочетаются с НАСГ при менее выраженном фиброзе. В 58% случаев нарушаются показатели обмена железа (повышение уровня ферритина и насыщения трансферрина в плазме). Даже при повышении содержания ферритина в плазме в 5 раз гистологические признаки гемохроматоза не развиваются. Поскольку обычные показатели функции печени неспецифичны, их определение не имеет значения при диагностике НАСГ и его дифференциации с невоспалительной жировой инфильтрацией печени. [17].Розулип - эффективное средство против атеросклероза.
Врачи мира против платной медицины
Повышенный холестерин в крови. Причины, симптомы, признаки. Атеросклероз-инсульт, инфаркт разрыв и отслойка сетчатки глаз, гангрена, ампутация конечностей БЕСПЛАТНАЯ КОНСУЛЬТАЦИЯ, НАБЛЮДЕНИЕ ЗА ПАЦИЕНТОМ ЛЕЧЕНИЕ АКЦИЯ С 1 ПО 31 ОКТЯБРЯ. Врач-специалист по атеросклерозу (ЛИПИДОЛОГ) ВЫСШЕЙ КАТЕГОРИИ К.М.Н. ФИО ВРЕМЯ РАБОТЫ БУДЕТ ОПУБЛИКОВАНО В АВГУСТЕ 2012 ГОДА.
Атеросклероз «Новые» статины – новые возможности для врача и пациента
РУССКИЙ МЕДИЦИНСКИЙ ЖУРНАЛ
«Новые» статины – новые возможности для врача и пациента
1832
Житникова Л.М.
Сердечно–сосудистые заболевания (ССЗ) вносят наибольший (57%) вклад в смертность от неинфекционных заболеваний (НИЗ) в Российской Федерации, при этом около 40% всех смертей приходится на возраст населения от 25 до 64 лет [1]. По данным ГНИЦ ПМ, в РФ почти 10 млн трудоспособного населения страдают ишемической болезнью сердца (ИБС), более трети больных имеют стабильную стенокардию.
Как правило, в основе большинства ССЗ, таких как ИБС, инфаркт миокарда (ИМ), мозговой инсульт (МИ), заболевания периферических артерий, лежит атеросклероз, одним из ведущих факторов развития которого является нарушение обмена липидов [2].
За последние годы представления о механизмах атерогенеза существенно расширились [3,4]. Дислипидемия (ДЛП) диагностируется при нарушении соотношения в плазме крови одного или нескольких классов липопротеинов. При этом их общее содержание может быть нормальным или повышенным. Наибольшее значение имеет увеличение холестерина (ХС) липопротеинов низкой плотности (ЛПНП) и снижение ХС липопротеинов высокой плотности (ЛПВП).
К липидам плазмы крови относятся: ХС, триглицериды (ТГ), фосфолипиды, жирные кислоты. ХС может быть свободным и этерифицированным. Свободный ХС участвует в синтезе стероидных гормонов, образовании жирных кислот, входит в состав нервной ткани и клеточных мембран. Этерифицированный ХС является результатом соединения с жирными кислотами, обнаруживается преимущественно в коре надпочечников, плазме крови, атеросклеротических бляшках. Триглицериды представляют собой эфиры жирных кислот, глицерина, входят в состав липопротеинов (ЛП), в основном хиломикронов и липопротеинов очень низкой плотности (ЛПОНП). Содержание жирных кислот и фосфолипидов в крови не связано с риском развития ИБС, поэтому они не обладают диагностической ценностью. Липопротеины представляют собой липид–белковые образования, состоящие из апобелков, ХС, триглицеридов и жирных кислот.
Наибольшее значение в развитии атеросклероза имеют ЛПНП (атерогенные ЛП) и ЛПВП (антиатерогенные ЛП). ЛПНП подвергаются перекисному окислению, активируют моноциты, проникают в субэндотелиальное пространство сосудов, превращаются в макрофаги, а затем в пигментные клетки и играют важную роль в формировании атеросклеротической бляшки. Поэтому ЛПНП являются главной мишенью гиполипидемической терапии. Так, снижение ХС ЛПНП на 1% снижает риск развития ИБС также на 1%. ЛПВП осуществляют обратный транспорт ХС из сосудистой стенки и макрофагов в печень. Их уровень в крови обратно коррелирует с риском развития атеросклероза (АС). Поэтому повышение ХС ЛПВП на 1% снижает риск развития ИБС на 3%.
Для успешного лечения больных целесообразно воздействовать на более ранние звенья в цепи: от факторов риска к основным сердечно–сосудистым заболеваниям, их осложнениям и гибели пациента.
К липидмодифицирующим медикаментозным средствам, исходя из их химического строения, относятся:
1. Фибраты (фенофибрат, ципрофибрат, гемфиброзил).
2. Анионобменные смолы (колестипол, холестирамин).
3. Статины (ловастатин, правастатин, симвастатин, флувастатин, аторвастатин, розувастатин).
4. Препараты разных химических групп (пробукол, ?–3–полиненасыщенные жирные кислоты, никотиновая кислота, секвестранты желчных кислот, жирорастворимые витамины, антиоксиданты и др.)
В основе гиполипидемического эффекта всех перечисленных препаратов лежит их способность снижать содержание в плазме крови атерогенных липопротеинов (ЛП): липопротеинов очень низкой плотности (ЛПОНП), ЛПНП и входящих в их состав липидов – ХС и ТГ.
На современном этапе развития медицины основным классом липидснижающих препаратов, использующихся в лечении ИБС, являются статины, имеющие существенную доказательную базу.
Статины являются структурными ингибиторами фермента гидрокси–метилглутарил–коэнзим–А–редуктазы (ГМГ–КоА), основного фермента, регулирующего биосинтез ХС в гепатоцитах. В результате снижения внутриклеточного содержания ХС гепатоцит увеличивает количество мембранных рецепторов к ЛПНП на своей поверхности. Рецепторы связывают и выводят из кровотока атерогенные частицы ЛПНП и, таким образом, снижают концентрацию ХС в крови.
Статины обладают сосудистыми и плейотропными эффектами. На уровне сосудистой стенки они за счет уменьшения образования холестерина и ЛПНП увеличивают соотношение ЛПВП/ЛПНП, снижают включение холестерина в субинтиму сосудов, способствуют стабилизации уже существующих атеросклеротических бляшек за счет уменьшения липидного ядра, а следовательно, снижают риск разрыва бляшки и тромбообразования. Улучшение функционального состояния эндотелия сосудов на фоне терапии статинами связывают не только с их основным действием, но и с плейотропными эффектами.
Плейотропными называются клинические эффекты, не связанные с основным механизмом действия, или иначе, с основным назначением данного лекарства. К таким эффектам относятся: сохранение и восстановление барьерной функции эндотелия, увеличение выработки оксида азота (NO) и, как следствие, вазодилатация, уменьшение агрегации тромбоцитов, тромбогенности, активация фибринолиза, уменьшение гипертрофии левого желудочка, антипролиферативный (по отношению к гладкомышечным клеткам), противовоспалительный (снижают уровень С–реактивного протеина – маркера воспалительной реакции в сосудистой стенке), антиаритмический, антихолелитиазный и некоторые другие эффекты [5]. Многие из этих свойств являются общими для всех статинов, хотя и существуют индивидуальные различия как в числе плейотропных эффектов, так и в степени их выраженности. Некоторые свойства обусловлены и гиполипидемическим, и плейотропным механизмами действия статинов.
Не последнюю роль в формировании дисфункции эндотелия наряду с уже известными факторами риска ИБС и ССЗ играет гипергомоцистеинемия, в том числе в увеличении риска развития острых коронарных событий. Статины способны уменьшать дисфункцию эндотелия, вызванную гипергомоцистеинемией, что может рассматриваться как еще один, нелипидный, эффект статинов [6].
Статины различают по способу их получения: так, симвастатин, ловастатин и правастатин являются природно–синтезированными соединениями, получаемыми из продуктов жизнедеятельности некоторых видов грибов, в то время как флувастатин, аторвастатин и розувастатин являются синтезированными препаратами.
В России зарегистрированы статины: симвастатин, ловастатин, правастатин, флувастатин, аторвастатин и розувастатин. Статины наиболее эффективно снижают уровень ЛПНП, при этом действие является дозозависимым. Каждое удвоение дозы статина приводит к дополнительному снижению уровня ЛПНП на 6% («правило шести процентов»). Статины снижают уровень триглицеридов на 10–15% и повышают уровень ЛПВП на 8–10%.
Общепринятой классификации статинов нет, обычно статины указывают в хронологическом порядке, согласно их появлению. Можно классифицировать статины по гидрофильности, по их метаболизму системой цитохрома Р450, по силе гиполипидемического действия. В таблицах 1 и 2 приведены основные характеристики статинов [7,8]. Основные препараты этой группы и их международные и торговые названия представлены в таблице 2.
Ловастатин – начальная доза 20 мг 1 раз/сут. сразу после ужина; целевого содержания холестерина ЛПНП в большинстве случаев удается достичь при назначении 40 мг/сут. В настоящее время ловастатин практически не применяется ввиду появления более современных статинов.
Симвастатин по эквивалентности вдвое сильнее ловастатина, т.е. прием 10 мг/сут. симвастатина дает такое же снижение ХС ЛПНП, как прием 20 мг/сут. ловастатина. Начальная доза – 10–20 мг 1 раз/сут.; целевое содержание обычно достигается при 40 мг; максимальная доза – 80 мг.
Правастатин назначается в дозе 20–40 мг/сут. В дозе 80 мг не изучен и обычно не используется.
Флувастатин назначается в дозе 20–40 мг/сут., но чаще в форме замедленного высвобождения 80 мг 1 раз/сут. С учетом особенностей фармакокинетики (высокая селективность действия в печени и метаболизм через изоформу 2С9 цитохрома Р–450) флувастатин назначают больным после трансплантации органов, получающим цитостатики.
Аторвастатин – синтетический статин 3–й генерации. По эквивалентной эффективности вдвое превосходит флувастатин. Терапию начинают с дозы 10–20 мг/сут.; при отсутствии эффекта для достижения целевого уровня дозу можно увеличить до 40 мг. Больным с острым коронарным синдромом или относящимся к категории очень высокого риска аторвастатин рекомендуется назначать в дозе 80 мг/сут.
Розувастатин назначается в дозе 5–10 мг/сут.; максимальная доза, используемая преимущественно у больных с тяжелым течением семейной гиперхолестеринемии, составляет 40 мг/сут.
Особенностью статинов нового поколения (аторвастатин, розувастатин) является то, что они способны снижать уровень ХС у больных с резистентностью к другим гиполипидемическим средствам. Эти препараты оказывают более выраженный гиполипидемический эффект по сравнению с другими статинами. Кроме того, эффективность аторвастатина и розувастатина связывают с тем, что они значительно снижают уровень ТГ и лучше повышают уровень ЛПВП.
Несмотря на обширную доказательную базу исследований, подтвердивших эффекты статинов в первичной и вторичной профилактике сердечно–сосудистых заболеваний, эта группа лекарственных средств недостаточно широко используется в клинической практике. Правила постоянного и контролируемого приема статина кажутся простыми и очевидными, однако именно их несоблюдение сводит на нет все усилия и саму возможность эффективного контроля атеросклероза и его осложнений. Такая ситуация в лечении гиперлипидемии характерна не только для отечественной амбулаторной практики, но и для многих других стран. Формальное отношение к лечению гиперлипидемии – вероятно, самая распространенная и самая опасная причина безуспешного лечения атеросклероза, поскольку она наносит двойной вред: вводит в заблуждение и врача, и больного. Врач должен не просто формально назначать лечение статином, а регулярно контролировать его эффективность и знать, что ХС больного на фоне лечения удерживается на требуемом целевом уровне; пациент должен не только регулярно принимать таблетки, но и быть уверенным, что они снизили его ХС до нормального уровня.
Очень часто врачи испытывают трудности при выборе препарата из группы статинов. Однако ряд исследований позволяет выделить несколько препаратов, которые наиболее целесообразно применять в нашей практике. Как известно, при выборе препарата врач должен учитывать такие показатели, как высокая эффективность, безопасность и экономичность длительной терапии. Одним из препаратов, соответствующих этим требованиям, является розувастатин.
Розувастатин является синтетическим статином III генерации. Молекула розувастатина гидрофильнее молекул других статинов, высокоселективна к мембранам гепатоцитов и оказывает гораздо более выраженное ингибирующее влияние на синтез ХС ЛПНП, чем другие статины. Выраженный ХС–снижающий эффект розувастатина связан и с продолжительным периодом его полувыведения (19 ч), что позволяет длительно блокировать активность ключевого фермента биосинтеза ХС. Розувастатин – один из немногих статинов, под влиянием которого активизируется синтез основного белка ЛПВП – аполипопротеина (АПО) АI: он повышается на разных дозах от 5 до 15%. Препарат применяется в дозах 5–40 мг. Стартовая доза – 5–10 мг. Терапевтический эффект розувастатина появляется в течение 1 нед. после начала терапии, через 2 нед. лечения достигает 90%. Максимальное действие препарата регистрируется обычно к 4–й нед. и поддерживается при постоянном приеме.
Рядом сравнительных исследований доказана высокая гиполипидемическая активность розувастатина (STELLAR – Statin Therapies for Elevated Lipid Levels compared Across doses to Rosuvastatin). Розувастатин в дозе 40 мг снижал уровень ХС ЛПНП на 55%, ТГ – на 34% и повышал уровень ХС ЛПВП на 10%, т.е. превосходил по этим показателям все другие статины [9].
В двух исследованиях MERCURI (Measuring Effective Reductions in Cholesterol Using Rosuvastatin therapy – изучение эффективности снижения холестерина с использованием розувастатина), MERCURI I и MERCURI II, у пациентов высокого риска было показано преимущество розувастина в дозе 10–20 мг/сут. по сравнению с эквивалентными дозами аторвастатина, симвастатина и правастатина в достижении целевого уровня ХС ЛПНП, согласно критериям NCEP ATP III (National Cholesterol Education Program. Adult Treatment Panel III – Национальная образовательная программа США по снижению холестерина, III пересмотр по терапии у взрослых) и EAS (Европейского общества по атеросклерозу) [10,11].
Изучение влияния розувастатина на риск развития сердечно–сосудистых осложнений, сердечно–сосудистую и общую смертность при различных ССЗ и у практически здоровых людей с повышенным сердечно–сосудистым риском (AURORA, CORONA, JUPITER ) показало, что [12]:
1) комбинированный риск инфаркта миокарда, инсульта или сердечно–сосудистой смерти снизился почти в 2 раза (47%, р<0,00001);
2) риск инфаркта миокарда уменьшился более чем в 2 раза (54%, р=0,0002);
3) риск инсульта снизился практически в 2 раза (48%, р=0,002); общая смертность значительно снизилась (на 20%, р=0,02).
Эти результаты сопровождались достоверным снижением уровня ХC ЛПНП в среднем на 50% (р<0,0001) c достижением среднего уровня ХС ЛПНП 1,42 ммоль/л (55 мг/дл). Следовательно, длительная терапия розувастатином в дозе 20 мг/сут. значительно снижает риск развития ССЗ у практически здоровых мужчин и женщин без гиперлипидемии, но с повышенными концентрациями высокочувствительного С–реактивного белка [13–16].
Особый интерес у клиницистов вызывает возможность статинов не только предотвращать или замедлять развитие, но и уменьшать размер уже существующей атеросклеротической бляшки (АБ). Подтверждено влияние розувастатина на атеросклеротическое поражение коронарных и сонных артерий, а также показана его возможность вызывать умеренную регрессию коронарного атеросклероза в исследованиях ASTEROID, METEOR, ORION [17,18]. Следует признать, что розувастатин отличается от других статинов своими фармакологическими свойствами, высокой липидснижающей активностью и клинической эффективностью, особенно у пациентов высокого риска сердечно–сосудистых осложнений, что делает его перспективным в профилактике органных поражений у больных атеросклерозом на всех стадиях развития процесса [19].
Для достижения максимального эффекта терапия статинами должна быть длительной, порой пожизненной. Одной из причин неоправданно редкого применения статинов является их высокая стоимость, особенно при длительном использовании.
Сегодня существует большое количество статинов, включающих в себя оригинальные препараты и их дженерики (аналоги). В России зарегистрировано более 30 дженериков статинов, но несмотря на их широкую распространенность, в медицинской среде до сих пор действует устойчивый стереотип, что оригинальные препараты безопаснее, эффективнее и надежнее дженериков. Статины–дженерики применяются в тех же дозах, что и оригинальные статины. Как правило, по гиполипидемической активности они не уступают оригинальным препаратам, но являются менее дорогостоящими, более экономически привлекательными, что помогает решить проблему их доступности более широкому кругу пациентов.
Врачи общей практики, терапевты, кардиологи могут с уверенностью рекомендовать пациентам с ДЛП прием дженериковых версий статинов для целей первичной и вторичной профилактики сердечно–сосудистых заболеваний, а также тяжелых ишемических исходов (смерть, инсульт, инфаркт).
симптомы вирусного гепатита С
1 2 3 4 5 6 7 8
9 10